Синдром болезненного мочевого пузыря /интерстициальный цистит: факторы прогноза клинического течения заболевания
А.В. Зайцев, М.Н. Шаров, О.А. Арефьева, Д.Ю. Пушкарь
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» МЗ РФ; Москва, Россия
Введение
Природа синдрома болезненного мочевого пузыря/интерстициального цистита (СБМП/ ИЦ) остается до конца неизвестной. Среди этиологических факторов рассматриваются аутоиммунные, аллергические, инфекционные, неврологические, сосудистые заболевания, а также инфильтрация стенки мочевого пузыря повышенным количеством тучных клеток, повреждение защитного слоя муцина и воздействие на стенку мочевого пузыря токсических субстанций, содержащихся в моче. Многообразие симптомов и различия в восприимчивости пациентов к лечению указывают на полиэтиологичность заболевания [1]. Название «интерстициальный цистит» нередко фокусирует внимание исследователей лишь на мочевом пузыре, в то время он может быть лишь местом сосредоточения действия различных этиологических факторов. Интерстициальный цистит, первоначально считавшийся заболеванием мочевого пузыря, в настоящее время подразумевает хронический болевой синдром. Понимание этого и привело в настоящей попытке пересмотреть название заболевания. В данном контексте термин синдром болезненного мочевого пузыря (СБМП) был признан более удачным новым названием для интерстициального цистита, поскольку это название находится в одном ряду с названиями других тазовых болевых синдромов и не противоречит клиническим проявлениям данного синдрома и знаниям его патофизиологии.
СБМП (BPS ⁄ IC) хроническое заболевание, при котором в биоптатах мочевого пузыря выявляется различная степень выраженности воспаления, фиброза детрузора и мастоцитоза. Клеточные механизмы воспаления при СБМП и процессы, приводящие к повреждению ткани и фиброзу, пока еще не совсем ясны [2, 3]. Вместе с тем результаты проведенных исследований показали, что фиброз и мастоцитоз детрузора связаны с необходимостью проведения различных видов лечения и предполагают неудачу стандартной терапии [4].
Выбор лечебной тактики должен основываться, насколько это возможно, на плацебо-контролируемых исследованиях; лечение начинают с менее инвазивных методов; планировать лечение на основании индивидуальных особенностей пациента; рассматривать применение более инвазивных методик только при отсутствии эффекта от преоральной фармакотерапии и внутрипузырного лечения; непроверенные методы лечения должны применяться в рамках клинических исследований; инвазивные оперативные методы должны применяться в последнюю очередь, за редким исключением.
Согласно рекомендациям Американской урологической ассоциации (AUA, 2011) лечение СБМП/ИЦ следует начинать с наиболее консервативных методик, а в случае их неэффективности переходить к менее консервативным методам. Вид лечения зависит от тяжести симптомов заболевания и предпочтений самого пациента. По истечению клинически значимого периода применение неэффективных методик прекращают. В интересах пациента следует проводить многоплановую, симультанную терапию. Это, прежде всего, относится к лечению тазовой боли, когда нередко необходим мультидисциплинарный подход. При неэффективности различных методов лечения следует провести пересмотр лечебной тактики и, возможно, клинического диагноза [5].
Пациентов, страдающих СБМП/ИЦ необходимо информировать о нормальной функции мочевого пузыря, характере заболевания, существующих методах лечения их риске, поведенческой терапии, средствах борьбы со стрессом, приводящим к усилению симптоматики. Вторым направлением в лечении СБМП/ ИЦ является применение мануальной терапии (воздействие на тазовые, абдоминальные и бедренные мышечные триггерные точки, протяженные мышечные контрактуры и рубцы). Вместе с тем, назначение упражнений, направленных на укрепление мышц тазового дна (например, гимнастика по Кегелю), является противопоказанным. Пероральная фармакотерапия заключается в назначении трициклических антидепрессантов (амитриптилин), антигистаминных препаратов (гидроксизина гидрохлорид) и блокаторов Н-2 рецепторов (циметидин), а также пентозанполисульфата (Elmiron®). Для внутрипузырной фармакотерапии рекомендованы диметилсульфоксид (ДМСО), гепарин и лидокаин в сочетании с кортикостероидами. В отличие от США, в Канаде и странах Европы для инстилляций в мочевой пузырь в настоящее время нередко применяют препараты, восстанавливающие защитный гликозаминогликановый слой: хондроитинсульфат (Gepan®), гиалуронат натрия (Cystistat®, Урогиал) или их комбинацию (Ialuril®).
Третьим направлением (уровнем) в лечении СБМП/ИЦ является цистоскопия под общей анестезией с гидробужированием мочевого пузыря. При выявлении участков Гуннеровского поражения выполняют их коагуляцию (гольмиевый лазер, электрокоагуляция) и/или введение в подслизистый слой триамцинолона.
К четвертому направлению лечения относятся различные методики нейростимуляции, включая имплантацию постоянного нейростимулятора. В урологической клинике МГМСУ, а также в ряде медицинских центров Европы на протяжении длительного времени применяют метод эндовезикального ионофореза (эндовезикального введения лекарственных препаратов под действием электрического постоянного тока).
Назначение циклоспорина А и внутридетрузорное введение ботулинического токсина типа А (botulinum toxin A, BTX-A) рассматриваются как пятое направление лечения СБМП/ИЦ.
Следует отметить, что в связи с отсутствием роста микрофлоры при бактериологическом исследовании у большинства больных СБМП/ИЦ и недоказанностью инфекционной теории его возникновения, длительное применение антибиотиков является неоправданным. Вместе с тем при выполнении эндовезикальных процедур и цистоскопии проводится антимикробная профилактика развития мочевой инфекции, при этом предпочтение отдается препаратам, обладающих доказанной эффективностью при однократном применении (например, фосфомицина трометамол).
У ограниченного контингента больных с потерянной емкостью мочевого пузыря, наличием мучительных тазовых болей и выраженной дизурией возможно выполнение ортотопической пластики мочевого пузыря, суправезикальной деривации мочи с – или без цистэктомии.
По мере накопления клинического опыта необходима критическая оценка эффективности и безопасности существовавших ранее и появляющихся новых методов лечения СБМП/ИЦ. Медикаментозное лечение, безусловно, имеет ряд преимуществ, однако эффективность медикаментозной терапии всецело зависит от совершенствования наших знаний об этиологии и патогенезе данного заболевания.
Материалы и методы
В университетской урологической клинике МГМСУ им. А.И. Семашко МЗ РФ с 2010 по 2014 гг. были обследованы 110 пациенток с СБМП. Хроническая тазовая боль и учащенное, болезненное мочеиспускание являются ведущими симптомами СБМП. Согласно заполнявшемуся дневнику мочеиспусканий максимальное количество мочеиспусканий в сутки у обследуемых пациенток составило 65, а минимальное – 14 (в ср. 25,32±7,5), при этом их беспокоили мочеиспускания, как в дневное, так и в ночное время суток практически в равном количестве (в среднем каждый час) (рис. 1).
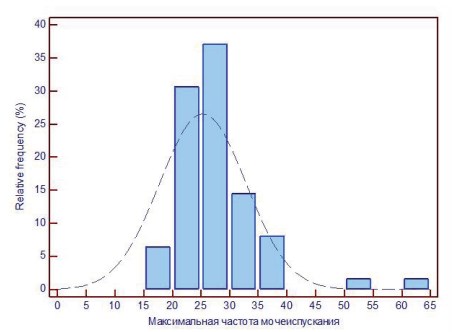
Рисунок 1. Гистограмма. Распределение пациенток по количеству мочеиспусканий в сутки
Выраженность болевого синдрома у пациенток оценивали по 10-бальной визуальной аналоговой шкале боли (ВАШ) (рис. 2). Среднее значение уровня боли по ВАШ составляло 6,9 ± 1,7 баллов, при этом 4% и 13% пациенток отметили максимально возможный балл (9 и 10 соответственно).
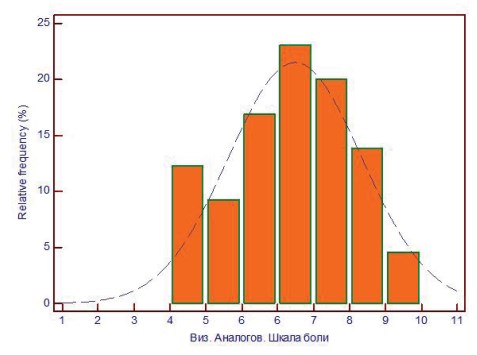
Рисунок 2. Гистограмма.Распределение пациенток по степени выраженности болевого синдрома
С помощью международных опросников: индекса симптомов и качества жизни больных интерстициальным циститом (Interstitial Cystitis Symptom and Problem Indexes, ICSI, ICPI) и шкалы симптомов тазовой боли, безотлагательности и частоты мочеиспусканий (the Pelvic Pain Urgency and Frequency Questionnaire, PUF) мы смогли в совокупности оценить выраженность симптомов дизурии и боли. Медиана индекса симптомов интерстициального цистита и качества жизни (O’Leary Sant IC) составила – 14 баллов, максимальный показатель – 20, минимальный – 10 (рис. 3). Как видно из диаграммы№3 у 27% пациенток наблюдалась максимальная выраженность СБМП, согласно количеству набранных баллов по опроснику. Следует так же отметить, что императивные позывы беспокоили 95% обследованных пациенток, при этом 50% из них испытывали их постоянно.
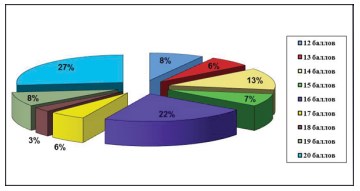
Рисунок 3. Диаграмма. Распределение пациенток согласно данным опросника «Индекс симптомов интерстициального цистита и качества жизни» (Interstitial Cystitis Symptom and Problem Indexes)
Качество жизни пациенток было проанализировано с помощью индекса качества жизни больных с интерстициальным циститом (ICPI). Все пациентки набрали более 10 баллов, что характерно для пациентов СБМП. Медиана по шкале ICPI составила 14 баллов, минимум – 10, максимум – 16. Как видно из рисунка 4, 51% пациенток набрали максимальное количество баллов, у них клинические проявления заболевания приводят к резкому затруднению социальной адаптации.
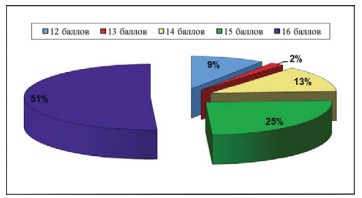
Рисунок 4. Диаграмма. Распределение пациенток согласно данным шкалы «Индекс качества жизни больных интерстициальным циститом (ICPI)»
Шкала симптомов тазовой боли, безотлагательности и частоты мочеиспусканий (PUF score) помимо симптомов дизурии дополнительно касается качества жизни больных и их сексуальной активности на фоне заболевания. Согласно указанному опроснику, средний балл составил 22, минимальный – 15, максимальный – 38 (рис. 5).
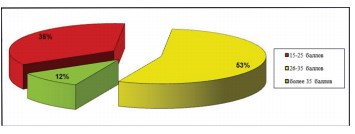
Рисунок 5. Диаграмма. Распределение пациенток согласно данным шкалы «Симптомы тазовой боли, безотлагательности и частоты мочеиспусканий (PUF)»
Важный аспект качества жизни пациенток, страдающих заболеваниями мочеполовых органов и/или нарушениями функции тазового дна, – сексуальная функция. Для оценки сексуальный функции пациенток был использован индекс женской сексуальной дисфункции (FSFI). Согласно этому опроснику 38% пациенток СБМП были сексуально неактивны, из них 60% обследованных избегали половых контактов вследствие выраженности симптомов СБМП, главным образом по причине наличия диспареунии. Среди 62% сексуально активных больных 53% имели различной степени выраженности сексуальную дисфункцию
При проведении оценки состояния пациенток, страдающих СБМП, необходимо уделять пристальное внимание изучению их психологического статуса. Для оценки этого статуса использовалась госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale), распределение пациенток по этому показателю представлено на рисунке 6. У 55% пациенток с СБМП помимо симптомов основного заболевания отмечаются тяжёлые депрессивные и тревожные расстройства.
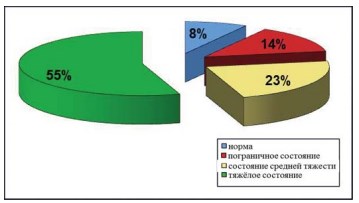
Рисунок 6. Диаграмма. Распределение пациенток согласно данным «Госпитальной шкалы тревоги и депрессии (HADS)».
Средний балл по шкале HADS составил 17,09 (ДИ 16.15-18.03) балла, медиана – 19,0 баллов, минимум – 4,0, максимум – 21,0 баллов.
Всем пациенткам с лечебно-диагностической целью была выполнена цистоскопия под общей анестезией. Биопсия мочевого пузыря произведена у 36 (33%) для исключения других заболеваний мочевого пузыря и патоморфологической оценки степени воспалительного процесса и выраженности фиброза детрузора. При цистоскопической картине Гуннеровских поражений во всех случаях в биоптатах выявлялась выраженная лимфогистиоцитарная инфильтрация, иногда с явлениями метаплазии эпителия и отека собственной пластинки слизистой оболочки, а фиброзносклеротические изменения в большинстве случаев затрагивали все слои стенки мочевого пузыря. При наличии выраженных изменений слизистой мочевого пузыря, визуализации участков Гуннеровского поражения у 60 (54%) пациенток проводилась их лазерная или электрокоагуляция. Цистоскопия под общей анестезией позволяет оценить также анатомическую емкость мочевого пузыря что невозможно сделать при обычной цистоскопии в амбулаторных условиях. Анатомическая ёмкостьмочевого пузыря у 65% пациенток составила 200-350 мл, а в 5% случаев было обнаружено ее снижение до 100 мл. Средняя ёмкость мочевого пузыря составила 297 ± 90,2 мл (рис. 7). Следует отметить, что при длительно существующем «язвенном» цистите эффективный объем мочеиспусканий у пациенток был не более 10 – 20 мл, в то время как у этих же пациенток интраоперационно анатомическая емкость достигала 400 мл. Известно, что в норме у женщин анатомическая емкость мочевого пузыря равняется 800 -1000 мл.
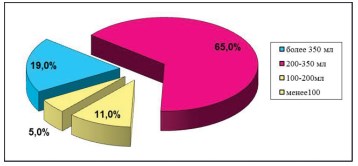
Рисунок 7. Диаграмма. Распределение пациенток в зависимости от величины анатомической ёмкости мочевого пузыря
Результаты
Результаты проведенного исследования позволяют считать значительное снижение анатомической емкости мочевого пузыря вследствие прогрессирующего воспаления и фиброза в стенке мочевого пузыря существенным фактором, влияющим на клиническое течение СБМП, обуславливающим выраженность, прежде всего орган – специфических симптомов заболевания.
Ранее нами были опубликованы результаты патоморфологических исследований биоптатов мочевого пузыря у больных СБМП [6,7]. Патоморфологические изменения у больных СБМП/ИЦ имеют прямую зависимость от степени выраженности изменений слизистой мочевого пузыря, выявленных при цистоскопии. Выявлена прямая корреляция показателей характера альтеративных изменений уротелия, степени выраженности воспалительной инфильтрации и выраженности боли, симптомов дизурии, в частности, частоты мочеиспусканий и императивных позывов, качества жизни и состояния психического здоровья. Степень выраженности фиброза, наличие пери неврита и мастоцитоза имеют прямую зависимость от продолжительности заболевания.
Пока этиология СБМП остается до конца неизвестной, лечение его является во многом эмпирическим. В лечении СБМП решающим фактором успеха является разработка и проведение многоплановой терапии. С учетом результатов патоморфологических исследований, свидетельствующих о преобладании явлений фиброзно-склеротического процесса в стенке мочевого пузыря у пациенток с СБМП, особенно в случаях наличия Гуннеровских поражений, необходимость включения в комплексную терапию препаратов с против склеротическим, антифиброзным действием не вызывает сомнений. Для лечения склеротического процесса в мочевом пузыре необходимо комплексное воздействие, как на сформировавшуюся соединительную ткань, так и на иммуно-воспалительный процесс, вызывающий ее формирование.
Клиника урологии МГМСУ располагает опытом применения с этой целью отечественного комплексного лекарственного препарата Лонгидаза (ООО «НПО Петровакс Фарм), представляющий собой коньюгат гиалуронидазы с высокомолекулярным носителем Поли-н-оксидом (активированным производным N – окиси полиэтиленпиперазина), аналогом иммуномодулятора Полиоксидония. Лонгидаза – комплексное лекарственное средство, обладающее ферментативной (гиалуронидазной) активностью пролонгированного действия. Лонгидаза обладает всем спектром фармакологических свойств, присущих лекарственным средствам с гиалуронидазной активностью, но терапевтический эффект Лонгидазы, как ферментного препарата, значительно выше благодаря пролонгированному действию, стабилизации фермента, повышению устойчивости к действию ингибиторов, наличию других фармакологических свойств, привнесенных в препарат носителем: хелатирующих, антирадикальных, иммуномодулирующих, противовоспалительных [8,9]. Всемирная организация здравоохранения (ВОЗ) в 2015 году присвоила препарату Лонгидаза международное непатентованное наименование (МНН), Лонгидаза зарегистрирована ВОЗ под МНН бовгиалуронидаза азоксимер (bovhyaluronidase azoximer) [10]. В проведенное ранее исследование нами были включены 60 больных в возрасте от 18 до 50 лет с СБМП/ ИЦ, которые были разделены случайным образом на две группы, сопоставимые по основным прогностическим признакам: опытная (30 человек) и контрольная (30 человек). Оценка эффективности лечения определяется в соответствии с положительной динамикой основных диагностических критериев (клинических и лабораторных), параметров иммунного статуса больных, а также эндоскопической картины и емкости мочевого пузыря. При этом отличия в исходах расценивались как влияние лонгидазы. Лечение препаратом лонгидаза 3000 МЕ в основной группе больных продолжалось в течение 50 дней (одна инъекция внутримышечно в 2 мл 0,5 % раствора новокаина через 5 дней, № 10) на фоне базисной терапии. Пациенты контрольной группы получали только базисную терапию.
На фоне проведения комплексной терапии с использованием препарата лонгидаза у 11 (36,7%) больных исчезли боли, интервал между мочеиспусканиями и его эффективный объем увеличился у 21 (70%) пациентки, при этом в 8 (26,7%) случаях прекратилась ноктурия. Терапевтический эффект оказался стойким и сохранился на протяжении 6 месяцев у 25 (83,3%) больных. Показатель максимального цистометрического объема (V цист. макс) в основной группе больных увеличился на 54,2+005 мл. Показатель детрузорного давления (Р дет.) уменьшился до 14,41+0,03 см Н2О. Величина показателя эластичности детрузора увеличилась сразу после курса лечения (+4.71+0,007 мл/см Н2О), а через 6 месяцев составила 49,83+0,08 мл/см Н2О, что выше исходного на 5,42+0,08 мл/см Н2О. При применении препарата лонгидаза не отмечено местных и общих побочных, а также аллергических реакций.
Результаты проведенного сравнительного исследования показали положительное влияние Лонгидазы за счет регресса иммуно-воспалительного процесса и увеличения эластичности детрузора, а также на такие показатели как уровень боли, интервал между мочеиспусканиями и эффективный объем мочевого пузыря. Наличие двух лекарственных форм этого препарата (для в/м введения и в виде ректальных свечей) дает широкие возможности для его применения в комплексном лечении пациентов этой группы [12].
Обсуждение
В данном исследовании мы стремились уточнить взаимосвязь между анатомической емкостью мочевого пузыря у пациентов с СБМП/ИЦ и клиническими проявлениями заболевания. Известно, что СБМП/ИЦ является гетерогенным синдромом, включающим в себя различные фенотипические подгруппы пациентов с соответствующими патогенетическими путями развития болезни. Некоторые факторы, приводящие к дисрегуляции и хронической тазовой боли не связаны со снижением емкости мочевого пузыря. Результаты показали, что психосоциальные факторы риска и диссоциативная патология позитивно коррелируют с анатомической емкостью мочевого пузыря.
Частота развития СБМП/ИЦ увеличивается с возрастом и пациентки с более тяжелым фенотипом заболевания (например, с Гуннеровскими поражениями мочевого пузыря) старше и имеют сниженную емкость мочевого пузыря. Возраст, продолжительность заболевания могут быть связанными со структурными изменениями в мочевом пузыре и воспалением. Помимо возраста, малая емкость мочевого пузыря существенно коррелировала с высокими показателями шкал оценки боли, ургентности и частоты мочеиспусканий. Следует согласиться с рядом исследователей, считающих СБМП/ИЦ со снижением емкости и Гуннеровскими поражениями отдельным клиническим подтипом заболевания.
Результаты пилотного исследования Colaco M. с соавт. (2014), показали, что у пациентов со сниженной анатомической емкостью мочевого пузыря (≤ 400 мл) профиль экспрессии генов в образцах слизистой оболочки мочевого пузыря отличается от показателей пациентов с емкостью >400 мл и людей в контрольной группе [11]. Профиль экспрессии генов в образцах из мочевого пузыря пациентов со сниженной емкостью был повышенным при воспалении и иммунном ответе, а снижение профиля экспрессии ключевых генов наблюдается в процессе поддержания барьерной функции уротелия. Таким образом, сниженная емкость мочевого пузыря может представлять отличительный признак, важный как в диагностике, так и в лечении данной подгруппы пациентов с СБМП/ИЦ.
Среди изученных неурологических симптомов и синдромов выявлена существенная положительная корреляция между увеличенной емкостью мочевого пузыря и диагнозом депрессия (p = 0.0059). Депрессия является общепризнанным коморбидным фактором при СБМП/ИЦ. В последующем анализе групп пациентов показана ассоциация именно боли с симптомами депрессии, а не с симптомами расстройств мочеиспускания. В клинических и научных исследованиях боль и расстройства мочеиспускания необходимо изучать и оценивать раздельно [12]. При обследовании 16185 пациентов с IC/BPS (ср. возраст 46 лет) и 32370 людей в контрольной группе частота депрессии, тревоги и инсомнии выявлялась значительно чаще в основной группе [13]. В другом исследовании, проведенном в рамках проекта Multidisciplinary Approach to Pelvic Pain (MAPP), также сообщалось, что среди неурологических синдромов, ассоциированных с СБМП/ИЦ, превалируют депрессия и тревога [14].
Продолжаются исследования, направленные на поиск биомаркеров СБМП. Представляют интерес полученные данные о значении гликопротерина YKL-40. Гликопротеин YKL-40 играет роль в процессах воспаления, усиливает трансформацию экстрацеллюлярного матрикса и фиброгенез в тканях человеческого организма. YKL-40 экспрессируется в различных типах клеток (например, тучных клетках, макрофагах, нейтрофилах, хондроцитах и гладкомышечных клетках сосудов) [15, 16]. Чрезмерная продукция YKL-40 может быть причиной накопления матрикса, приводящего к фиброзу ткани. Обнаружено увеличение концентрации YKL-40 в сыворотке крови и моче пациентов с СБМП. В частности, уровень данного гликопротеина был выше у пациентов с фиброзом детрузора по сравнению с теми, у которых он не выявлялся. Степень фиброза детрузора ассоциирована с количеством YKL40-позитивных клеток, тучных клеток и концентрации в моче YKL-40. Емкость мочевого пузыря обратно пропорционально коррелирует с количеством YKL40-позитивных и тучных клеток. YKL-40 обнаружен в гранулах тучных клеток при иммуноэлектронной микроскопии детрузора мочевого пузыря. Согласно этим данным тучные клетки экспрессируют и, вероятно, секретируют YKL-40 при СБМП. Тучные клетки содержат в гранулах различные медиаторы (например, цитокины, лейкотриены, гистамин, гепарин) и могут синтезировать YKL-40. Поскольку тучные клетки экспрессируют YKL-40 и существенно связаны с фиброзом детрузора, предполагалось, что YKL-40 может рассматриваться как воспалительный медиатор при BPS ⁄ IC, секретируемый этими клетками. Вовлечение YKL-40 в воспалительный процесс в мочевом пузыре усиливает перестройку экстрацеллюлярного матрикса, приводящее к фиброгенезу [17]. Существенное увеличение концентрации в сыворотке крови и моче YKL-40 у пациентов с BPS ⁄ IC, особенно с фиброзом детрузора по сравнению со здоровыми людьми подтверждает эту теорию. По мнению авторов исследования, YKL-40 может использоваться в качестве не инвазивного биомаркера фиброза детрузора. До настоящего времени наличие фиброза детрузора можно подтвердить лишь результатами патоморфологического исследования биоптатов мочевого пузыря [18].
Снижение анатомической емкости мочевого пузыря <400 мл также свидетельствует о нарушении эластичности его стенки и косвенно подтверждает наличие фиброза. Диагноз СБМП представляет значительные трудности в связи с гетерогенностью симптоматики заболевания и множеством сопутствующих коморбидных состояний. Ряд исследователей справедливо считают, что анатомическая емкость мочевого пузыря, установленная при его гидробужировании под общей анестезией, во многом определяет клинические проявления СБМП и взаимосвязана как с урологическими, так и неурологическими симптомами заболевания.
Walker S.J. с соавт. (2017) проанализировали наличие клинической симптоматики у 110 пациенток с СБМП, перенесших гидробужирование мочевого пузыря под общей анестезией. Для оценки симптомов, помимо детального изучения истории заболевания, использованы являющиеся «золотым стандартом» международные опросники: O’Leary/Sant Voiding & Pain Indices (ICPI & ICSI) и the Pelvic Pain Urgency and Frequency Questionnaire (PUF) [19]. Средний возраст пациенток составил 45,8 лет, а анатомическая емкость мочевого пузыря – 857 мл. Авторы выявили существенную обратную корреляцию между емкостью мочевого пузыря и баллами по трем основным шкалам оценки СБМП: ICPI (p=0.0014), ICSI (p=0.0022) и PUF (p=0.0009), а также частотой мочеиспусканий (p=0.0025). Пациентки с большей емкостью мочевого пузыря существенно чаще сообщали о депрессии (0.0059), и синдроме раздраженного кишечника СРК (IBS) (p=0.022). По мнению авторов данного исследования, низкая анатомическая емкость мочевого пузыря под общей анестезией существенно коррелирует с высоким баллом симптомов согласно трем валидизированным опросникам также, как и с частотой мочеиспусканий, но не ассоциирована с депрессией или другими системными болевыми синдромами. Результаты свидетельствуют, что низкая емкость мочевого пузыря является маркером манифестации орган центрического (моче пузырного) подтипа СБМП (IC/BPS).
Заключение
Сниженная емкость мочевого пузыря при цистоскопии под общей анестезией ассоциирована с высокими показателями основных валидизированных международных опросников, оценивающих клинические проявления СБМП/ИЦ, в тоже время частота мочеиспусканий не связана с депрессией или другими системными болевыми синдромами. Сниженная емкость мочевого пузыря является маркером поражения, в основном, мочевого пузыря при СБМП/ИЦ и характерна для определенной подгруппы пациентов, требующих проведения эндовезикального лечения в отличие от пациентов с системным фенотипом и коморбидными состояниями.
Литература
- van de Merwe JP, Nordling J, Bouchelouche P, Bouchelouche K, Cervigni M, Daha LK, Elneil S, Fall M, Hohlbrugger G, Irwin P, Mortensen S, van Ophoven A, Osborne JL, Peeker R, Richter B, Riedl C, Sairanen J, Tinzl M, Wyndaele JJ. Diagnostic criteria, classifi cation, and nomenclature for painful bladder syndrome ⁄ interstitial cystitis: an ESSIC proposal. Eur. Urol. 2008;53(1);60–67. DOI: 10.1016/j.eururo.2007.09.019
- Sant GR, Kempuraj D, Marchand JE, Theoharides TC. The mast cell in interstitial cystitis: role in pathophysiology and pathogenesis. Urology. 2007;69(Suppl.4); 34–40. DOI: 10.1016/j.urology.2006.08.1109
- Forrest JB, Moldwin R. Diagnostic options for early identification and management of interstitial cystitis ⁄ painful bladder syndrome. Int. J. Clin. Pract. 2008;62(12);1926– 1934. DOI: 10.1111/j.1742-1241.2008.01931.x
- Richter B, Hesse U, Hansen AB, Horn T, Mortensen SO, Nordling J. Bladder pain syndrome ⁄ interstitial cystitis in a Danish population: a study using the 2008 criteria of the European Society for the Study of Interstitial Cystitis. BJU Int. 2010;105(5); 660–667. DOI: 10.1111/j.1464- 410X.2009.08847.x
- AUA Clinical Guidelines. Diagnosis and Treatment Interstitial Cystitis/Bladder Pain Syndrome. Published 2011; Amended 2014 Режим доступа: https://www.auanet. org/guidelines/interstitial-cystitis/bladder-pain-syndrome- (2011-amended-2014)
- Зайцев А.В., Пушкарь Д.Ю., Корсунская И.Л., Ковылина М.В., Цыбуля О.А. Современные аспекты диагностики и лечения синдрома болезненного мочевого пузыря/ интерстициального цистита. РМЖ. 2010;18(381); 1084 -1089.
- Пушкарь Д.Ю., Зайцев А.В., Ковылина М.В., Цыбуля О.А., Васильев А.О. Гистоморфология уротелия при воспалительных заболеваниях мочевого пузыря. Вестник ВолГМУ. 2011;2:94-97.
- Пушкарь Д.Ю., Зайцев А.В. Лонгидаза в лечении больных интерстициальным циститом. Урология. 2007;5:35-37.
- Ковылина М.В., Зайцев А.В., Ибрагимов Р.А., Корсунская И.Л. Роль ферментных препаратов в комплексном лечении больных с синдромом болезненного мочевого пузыря/интерстициальным циститом. Эффективная фармакотерапия. Урология и нефрология. 2013;2(16):8-12.
- WHO Drug Information Vol. 29, No. 3, 2015 – Recommended International Nonproprietary Names, List 74. (2015; 130 pages) Режим доступа: htt p://apps.who.int/medicinedocs/ en/m/abstract/Js22124en/
- Colaco M, Koslov DS, Keys T, Evans RJ, Badlani GH, Andersson KE, Walker SJ. Correlation of gene expression with bladder capacity in interstitial cystitis/bladder pain syndrome. J Urol. 2014;192(4):1123-1129. DOI: 10.1016/j.juro.2014.05.047
- Griffith JW, Stephens-Shields AJ, Hou X, Naliboff BD, Pontari M, Edwards TC, Williams DA, Clemens JQ, Afari N, Tu F, Lloyd RB, Patrick DL, Mullins C, Kusek JW, Sutcliffe S, Hong BA, Lai HH, Krieger JN, Bradley CS, Kim J, Landis JR. Pain and urinary symptoms should not be combined into a single score: psychometric findings from the MAPP Research Network. J Urol. 2016;195(4P1):949-954. DOI: 10.1016/j. juro.2015.11.012
- Chuang YC, Weng SF, Hsu YW, et al. Increased risks of healthcare-seeking behaviors of anxiety, depression and insomnia among patients with bladder pain syndrome/ interstitial cystitis: a nationwide population-based study. Int Urol Nephrol. 2015;47(2):275-281. DOI: 10.1007/s11255- 014-0908-6
- Krieger JN, Stephens AJ, Landis JR, Clemens JQ, Kreder K, Lai HH, Afari N, Rodríguez L, Schaeff er A, Mackey S, Andriole GL, Williams DA; MAPP Research Network. Relationship between chronic nonurological associated somatic syndromes and symptom severity in urological chronic pelvic pain syndromes: baseline evaluation of the MAPP study. J Urol. 2015;193(4):1254-1262. DOI: 10.1016/j.juro.2014.10.086
- Bigg HF, Wait R, Rowan AD, Cawston TE. The mammalian chitinase-like lectin, YKL-40, binds specifi cally to type I collagen and modulates the rate of type I collagen fi bril formation. J. Biol. Chem. 2006;281(30);21082–21095. DOI: 10.1074/jbc.M601153200
- 16. Johansen JS. Studies on serum YKL-40 as a biomarker in diseases with infl ammation, tissue remodelling, fi brosis and cancer. Dan. Med. Bull. 2006;53(2);172–209. PMID: 17087877
- Letuve S, Kozhich A, Arouche N, Grandsaigne M, Reed J, Dombret MC, Kiener PA, Aubier M, Coyle AJ, Pretolani M. YKL-40 is elevated in patients with chronic obstructive pulmonary disease and activates alveolar macrophages. J. Immunol. 2008; 181(7); 5167–5173. DOI: 10.4049/jimmunol.181.7.5167
- Richter B, Roslind A, Hesse U, Nordling J, Johansen JS, Horn T, Hansen AB. YKL-40 and mast cells are associated with detrusor fi brosis in patients diagnosed with bladder pain syndrome⁄ interstitial cystitis according to the 2008 criteria of the European Society for the Study of Interstitial Cystitis. Histopathology. 2010;57(3):371–383. DOI: 10.1111/j.1365- 2559.2010.03640.x
- Walker SJ, Zambon J, Andersson KE, Langefeld CD, Matt hews CA, Badlani G, Bowman H, Evans RJ. Bladder Capacity is a Biomarker for a Bladder Centric versus Systemic Manifestation in Interstitial Cystitis/Bladder Pain Syndrome. J Urol. 2017;198(2):369-375. DOI: 10.1016/j.juro.2017.02.022.
Статья опубликована в журнале “Вестник урологии” №3 2018, стр. 26-34