Промежностная радикальная простатэктомия
Е.А. Безруков
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ; Москва, Россия
Введение
В настоящее время методика промежностной радикальной простатэктомии (РПЭ) переживает период возрождения ввиду своей малотравматичности и экономической выгодности, а также малого количества осложнений. Операция отличается малоинвазивным доступом, хорошей визуализацией предстательной железы (особенно верхушки), мочеиспускательного канала, и сосудисто-нервных пучков, даёт хороший косметический эффект. Хирургический доступ проходит вдалеке от крупных сосудов и нервов. К преимуществам также можно отнести возможность надёжного и быстрого формирования пузырно-уретрального анастомоза. Операция удобна у тучных пациентов, пациентов после обширных операций на брюшной полости. Ввиду последних модификаций, промежностная простатэктомия позволяет выполнять нервосберегающее вмешательство, а также вмешательство с одновременной трансперитонеальной лимфаденэктомией.
История
Именно хирургический доступ через промежность был первым, предложенным для осуществления простатэктомии. Впервые технику такой операции разработал и описал ещё в 1867 году C. A. Theodore Billroth. На тот момент операция не получила распространения ввиду высокой сложности и большого количества осложнений. Кроме того, сама проблема рака простаты была мало изучена, ведь это заболевание известно только с 1853 года благодаря работам James Adams, английского хирурга [1]. За неимением маркёра и визуализирующих методов диагностики, выявляемость рака простаты была крайне низкой, и многие пациенты даже по современным воззрениям были неоперабельными.
Следующую попытку совершенствования операции предпринял Hugh H. Young в 1905 году [2], им был применён доступ от переднего края внешнего прямокишечного сфинктера до ректоуретральной мышцы. Чтобы сделать мобилизацию простаты более удобной, Young разработал ретрактор особой формы, впоследствии названный его именем.
Elmer Belt в 1942 году модифицировал доступ Young следующим образом: мышечные волокна внешней и внутренней частей внешнего прямокишечного сфинктера отводятся кверху и латерально, при этом доступ к предстательной железе осуществляется по передней поверхности прямой кишки. Надсфинктерный доступ по Young является более сложным, но обеспечивает более короткий путь к простате [3]. До 70-80-х годов XX века подсфинктерный доступ Belt использовался урологами для лечения пациентов с локализованным, малоразмерным раком предстательной железы, выявленным на ранних стадиях.
В то же время, с 1941 года известна позадилонная РПЭ. Позадилонный доступ традиционно более знаком врачам из общей хирургии, а также из урологических операций на мочевом пузыре и нижней трети мочеточника. Именно с его появлением промежностные операции были порой незаслуженно забыты, хотя даже в 1982 году Patrick C. Walsh советовал применять позадилонную простатэктомию только лишь на тех стадиях онкопроцесса, при которых была необходима лимфодиссекция [4].
Последнюю модификацию промежностной операции предложил Jeff rey P. Weiss, он же провёл первую нервосберегающую промежностную РПЭ [5]. Данная методика является наиболее эффективной по сей день [6].
В настоящее время методика промежностной РПЭ переживает период возрождения ввиду своей малотравматичности и экономической выгодности, а также малого количества осложнений. Операция отличается малоинвазивным доступом, хорошей визуализацией предстательной железы (особенно верхушки), мочеиспускательного канала, и сосудисто-нервных пучков, даёт хороший косметический эффект. Хирургический доступ проходит вдалеке от крупных сосудов и нервов. К преимуществам также можно отнести возможность надёжного и быстрого формирования пузырно-уретрального анастомоза. Операция удобна у тучных пациентов, пациентов после обширных операций на брюшной полости [7]. Ввиду последних модификаций, промежностная простатэктомия позволяет выполнять нервосберегающее вмешательство, а также вмешательство с одновременной трансперитонеальной лимфаденэктомией.
Отбор пациентов и показания к промежностной простатэктомии
Выбор вида операции во многом обусловлен опытом и убеждениями хирурга, оснащённостью лечебного учреждения и желаниями пациента. Любую из видов РПЭ при необходимости можно сочетать с нервосбережением и с лимфаденэктомией (но после промежностной РПЭ для этого потребуется отдельный доступ). Различия между методиками заключаются только в виде доступа к простате и в функциональных результатах, онкологические результаты и процент осложнений принципиально не отличаются. Тем не менее, мы постараемся выделить объективные показатели, при которых промежностная РПЭ целесообразна, или, напротив, нерациональна.
С появлением эндоскопических методик сложилось мнение, что к малоинвазивным можно отнести только лапароскопическую или роботическую простатэктомии. Очевидно, что они отличаются от позадилонной операции маленькими размерами разрезов и хорошим косметическим эффектом, снижением болевого компонента. Также сообщается о меньшей кровопотере и возможностям более тщательного сохранения сосудисто-нервных пучком. Такое мнение имеют многие мировые издания, которые не имеют достаточного фактического материала по промежностной операции ввиду её редкого применения. Особенно это характерно для США, где роботическая РПЭ применяется чаще других методов. Так, в Duke Center, промежностная РПЭ практически не использовалась до 2003 года. Между 2003 и 2005, доля позадилонной, лапароскопической и роботической были 56,7%, 14,9% и 28,4% соответственно. Позже, количество открытых пособий снизилось до 55,4%, лапароскопических – до 3,5%, в то время как роботических операций стало 41,1%. Данная тенденция прослеживалась и в 2007 году: доля роботических РПЭ увеличилась до 63%, позадилонных – снизилась до 36%, а лапароскопических составила менее 1%. Кроме того, подчас коммерческая заинтересованность вносит вклад в выбор метода. В принципе, промежностная операция может быть выполнена практически теми же инструментами, что и позадилонная, в то время как для лапароскопической потребуется большое количество специализированного оборудования, подчас одноразового.
С появлением эндоскопических методик сложилось мнение, что к малоинвазивным можно отнести только лапароскопическую или роботическую простатэктомии. Очевидно, что они отличаются от позадилонной операции маленькими размерами разрезов и хорошим косметическим эффектом, снижением болевого компонента. Также сообщается о меньшей кровопотере и возможностям более тщательного сохранения сосудисто-нервных пучком. Такое мнение имеют многие мировые издания, которые не имеют достаточного фактического материала по промежностной операции ввиду её редкого применения. Особенно это характерно для США, где роботическая РПЭ применяется чаще других методов. Так, в Duke Center, промежностная РПЭ практически не использовалась до 2003 года. Между 2003 и 2005, доля позадилонной, лапароскопической и роботической были 56,7%, 14,9% и 28,4% соответственно. Позже, количество открытых пособий снизилось до 55,4%, лапароскопических – до 3,5%, в то время как роботических операций стало 41,1%. Данная тенденция прослеживалась и в 2007 году: доля роботических РПЭ увеличилась до 63%, позадилонных – снизилась до 36%, а лапароскопических составила менее 1%. Кроме того, подчас коммерческая заинтересованность вносит вклад в выбор метода. В принципе, промежностная операция может быть выполнена практически теми же инструментами, что и позадилонная, в то время как для лапароскопической потребуется большое количество специализированного оборудования, подчас одноразового.
Промежностный доступ особенно удобен у пациентов, страдающих ожирением, у которых жировой фартук препятствует трансабдоминальной хирургии – даже в этом случае допуск к простате легко осуществим. Консолидация тканей в таком случае также быстрее, в то время как в случае нижней срединной лапаротомии нередко бывает несостоятельность раны.
Лимфаденэктомия (ЛАЭ) является также важной темой для обсуждения. Оппоненты методики указывают, что промежностный доступ исключает одновременную лимфаденэктомию, в связи, с чем требуется отдельная процедура, обычно – лапароскопическая лимфаденэктомия. Возможно выполнить эти операции одномоментно, тем не менее, длительность такого вмешательства будет несравнимо больше, чем, например, лапароскопической РПЭ+ЛАЭ.
Исходя из вышеперечисленного, можно сформулировать показания и противопоказания с промежностной РПЭ следующим образом (в данный список мы не включаем показания к простатэктомии в принципе, чтобы акцентировать внимание именно на выборе промежностного доступа). Также стоит отметить, что эти показания и противопоказания являются рекомендуемыми, но не абсолютными.
Показания:
- Локализованный рак простаты низкого онкологического риска (стадия Tlc-T2aN0 M0 , уровень ПСА < 10 нг/мл, сумма баллов по шкале Глисона≤6 баллов).
- Локализованный рак простаты умеренного онкологического риска (стадия T2bN0M0, или уровень ПСА 10-20 нг/мл, или сумма баллов по шкале Глисона =7 баллов) при отсутствии показания для выполнения лимфаденэктомии по данным номограмм и МРТ с контрастированием.
- Объём предстательной железы < 60 см3 .
- Выраженное ожирение
- Предшествующие обширные хирургические вмешательства на брюшной полости
Противопоказания:
- Рак простаты высокого и очень высокого онкологического риска (стадия начиная с T2cN0 M0 , или уровень ПСА ≥20 нг/мл, или сумма баллов по шкале Глисона ≥8 баллов.
- Рак простаты умеренного онкологического риска при наличии показания для лимфаденэктомии по данным номограмм.
- Маленькое расстояние между седалищными буграми
- Невозможность укладки пациента (патология тазобедренных суставов, сердечная недостаточность)
Техника выполнения промежностной радикальной простатэктомии
Укладка пациента в позицию для литотомии (рис. 1). Используют специальные фиксирующие устройства для ротации ног кнаружи. Под крестец подкладывается валик таким образом, чтобы после установки стола в положение Тренделенбурга промежность оказалась параллельной полу. Данное условие необходимо для лучшей визуализации всех этапов операции, особенно выделения верхушки железы. Также рекомендуется использовать плечевые подпоры, проложенные гелевыми прокладками. Использование мягких прокладок позволит избежать постоперационного плексита. U-образный кожный разрез проводят на расстоянии 1,5 – 2 см от ануса, отступя медиальнее на 1 см от седалищных бугров (рис. 2).
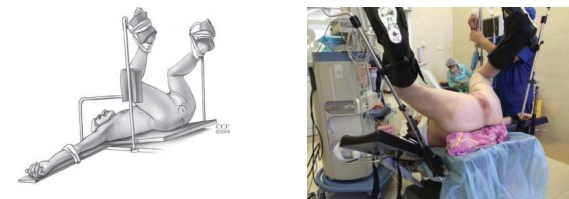
Рисунок 1. Положение больного на операционном столе
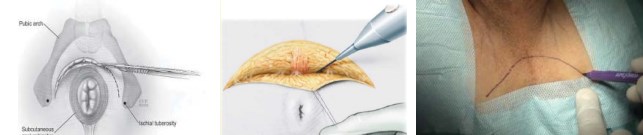
Рисунок 2. U-образный кожный разрез
После рассечения кожи и клетчатки доступ осуществляют через сухожильный центр промежности, с сохранением мышц и сосудов промежности (рис. 3).
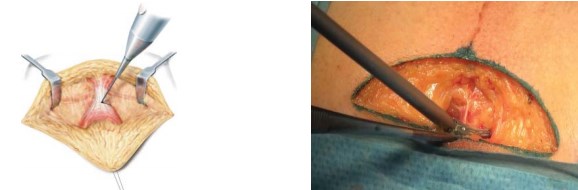
Рисунок 3. Выделение и рассечение сухожильного центра промежности
Мобилизация предстательной железы. После рассечения кожи, подкожно-жировой клетчатки и поверхностной фасции производят выделение и рассечение сухожильного центра промежности. Мобилизацию простаты от мышц, поднимающих задний проход, производят тупым и острым путём. На этом этапе удобно применять современные методы для диссекции и коагуляции тканей, например, ультразвуковой скальпель-диссектор, которым можно работать даже вблизи сосудов и удобно достичь любой части раны. Также применяют пальцевую диссекцию (рис. 4).
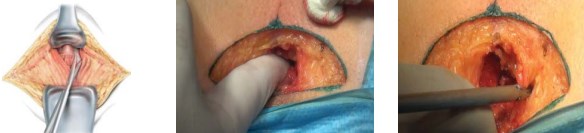
Рисунок 4. Мобилизация простаты от мышц, поднимающих задний проход
Далее, производят выделение и пересечение задней поверхности дистальной части уретры под непосредственнымвизуальнымконтролем (рис. 5).
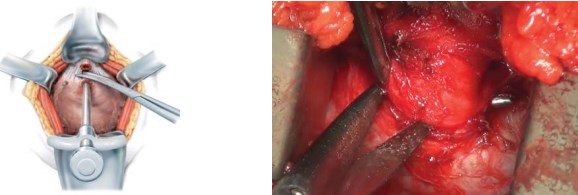
Рисунок 5. Выделение и пересечение задней поверхности дистальной части уретры
В дальнейшем на дистальную часть уретры накладывают 6 провизорных лигатур монофиломентной нитью Monocryl 3-0. Лигатуры накладывают на 1, 3, 5, 7, 9, 11 часах условного циферблата. Затем пересекают переднюю поверхность уретры (рис. 6).
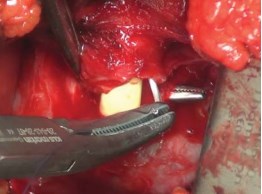
Рисунок 6. Наложение провизорных лигатур под визуальным контролем
Следующим этапом производят мобилизацию предстательной железы в области верхушки, передней и её боковых поверхностей, вплоть до шейки мочевого пузыря. Острым путём пересекают вначале переднюю, а затем и заднюю полуокружность шейки мочевого пузыря (рис. 7).
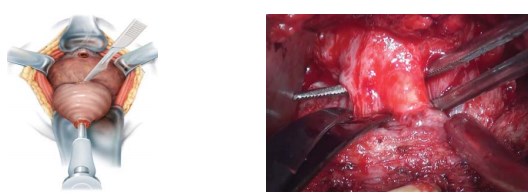
Рисунок 7. Выделение и пересечение шейки мочевого пузыря
После этого тупым и острым путём производят мобилизацию семенных пузырьков и семявыносящих протоков от стенки прямой кишки. Это возможно благодаря расширению пространства между фасцией Denonvilliers и фасцией прямой кишки. Семявыносящие протоки пересекают, семенные пузырьки мобилизуют без нарушения целостности. Простату удаляют (рис. 8).
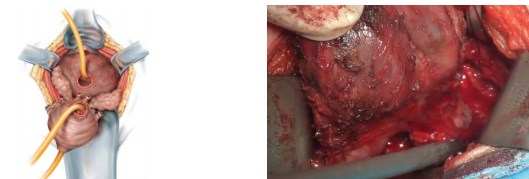
Рисунок 8. Мобилизация семенных пузырьков и семявыносящих протоков
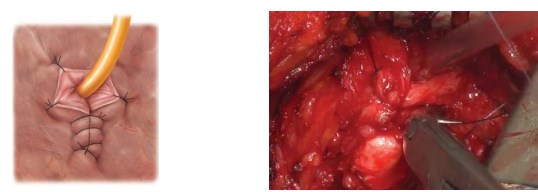
Рисунок 9. Пластика шейки мочевого пузыря по типу «теннисной ракетки»
Если после удаления органа диаметр шейки мочевого пузыря составляет больше 8-10 мм, производят пластику шейки мочевого пузыря по типу теннисной ракетки (рис. 9).
Наложение пузырно-уретрального анастомоза и ушивание раны. Мочевой пузырь дренируют уретральным катетером. Баллон уретрального катетера раздувают. Дистальную уретру анастомозируют с шейкой мочевого пузыря посредством предварительно наложенных провизорных лигатур. Герметичность анастомоза проверяют путём введения 150 мл физиологического раствора (рис. 10).
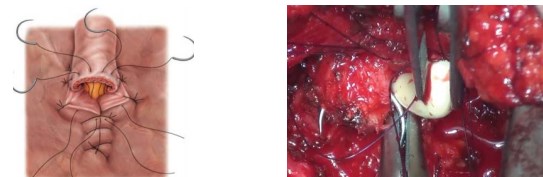
Рисунок 10. Формирование анастомоза
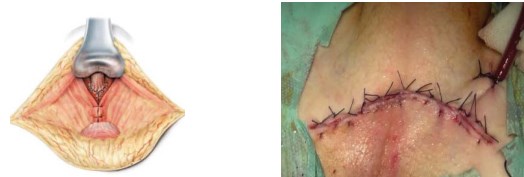
Рисунок 11. Послойное ушивание раны
Далее осуществляют окончательный гемостаз. Рану дренируют хлорвиниловой трубкой, и послойно ушивают, в послеоперационном периоде проводят активную аспирацию раневого отделяемого (рис. 11).
Осложнения промежностной радикальной простатэктомии
Наиболее серьёзными интраоперационными хирургическими осложнениями простатэктомии является вскрытие просвета прямой кишки и повреждение уретры. Повреждение прямой кишки возникает чаще при промежностной РПЭ по причине необходимости диссекции кишки на значительном протяжении. В среднем, травма прямой кишки при этом вмешательстве составляет до 5,5%, что существенно больше, чем, например, при позадилонной операции – 0,8% [8]. Как правило, при интраоперационном ушивании повреждения осложнений не возникает. Отдалённым последствием своевременно недиагностированного или неправильно ушитого повреждения кишки может стать прямокишечнопузырный свищ, наблюдаемый в 1,5-3,6%. Разрывы прямой кишки чаще всего возникают из-за небрежного, чрезмерного интраоперационного натяжения прямой кишки, в частности при работе с седалищно-прямокишечной ямкой и при тупой диссекции простаты. Во многих случаях профилактически выводится сигмостома, создающая условия для заживления места травмы. На наш взгляд, данный подход наиболее целесообразен, поскольку риск возникновения пузырнопрямокишечного свища существует. Сложность и длительность лечения этого осложнения значительно превосходят те неудобства, которые присуще колостоме.
Общий риск развития стриктуры уретры после радикальных методов простатэктомии варьируется от 1% до 15%. При промежностном доступе развитие стриктур возникает несколько реже (1-3,8%), что, возможно, связано с лучшей визуализацией уретры и формированием анастомоза без натяжения [9].
Несостоятельность анастомоза после простатэктомии возникает в среднем 5,5%. Даже при выполнении процедуры начинающим хирургом частота не превышает 22%, а в узкоспециализированных урологических центрах частоты несостоятельности анастомоза составляет в среднем 0,2%.
Самые современные исследования сообщают, что частота стриктур уретры составляют 4,8%, что в первую очередь связано с совершенствованием технического обеспечения. Незначительные кишечные расстройства (газы, запоры) характерны для всех методов РПЭ, однако для промежностной операции данные расстройства практически не характерны.
Послеоперационное недержание кала отмечается после промежностной РПЭ в 1-2% [10]. Стоит отметить, что среди пожилых мужчин, которым проводилась данная операция, в 19,2% недержание кала наблюдалось до операции.
Функциональные и онкологические результаты
Основные функциональные исходы операции – это качество удержания мочи и степень восстановления эректильной функции.
Благоприятный функциональный исход зависит не только от самой операции, но и от возраста пациента, предоперационного анамнеза, опыта хирурга, антропометрических особенностей пациента. Важна и техника операции. Промежностная операция отличается хорошей экспозицией верхушки простаты, удобным нервосбережением, удобным формированием анастомоза непосредственно под визуальным контролем.
Однако стоит отметить, что большинство исследовании не демонстрируют существенных различий между различными методиками РПЭ. Возврат к нормальной половой жизни, прежде всего, зависит от степени сохранения сосудистонервных пучков, что в свою очередь определяется опытом хирурга.
Онкологические результаты определяются не только качеством операции, но и точностью дооперационной диагностики. Отличие промежностной операции заключается в диссекции непосредственно вдоль капсулы железы. При наличии экстракапсулярного роста такая операция скорее всего не будет радикальной. Помимо этого, повлечь за собой возникновение положительного хирургического края может небрежная работа с капсулой. Значительная часть положительного хирургического края объясняется прежде всего чрезмерной тягой пубопростатических связок во время подготовки и выделения предстательнойжелезы. Статистические показатели говорят о том, что б/х рецидив в течение 2 лет после операции в случае недооценки стадии возникает, по данным различных источников, в 62-80% случаев [11]. Именно поэтому стоит отметить, что послеоперационный прогноз зависит в большей степени от патоморфологической стадии онкопроцесса – данные показатели напрямую коррелируют.
Выводы
В настоящее время дебаты о превосходстве одной техники над другой остаются открытыми, хотя из всего вышесказанного становится понятно, что результаты различных методик находятся практически на одном уровне. Некоторые специалисты считают малоинвазивные методики золотым стандартом, тем не менее, данное утверждение не имеет в основе клинических доказательств. Все методы РПЭ дают эквивалентные результаты эффективности и безопасности, функциональных и онкологических исходов.
Говоря о конкретных методах:
- промежностная РПЭ – малоинвазивная и наиболее экономически выгодная операция,
- роботическая РПЭ – высокоэффективная процедура, однако, чрезвычайно дорогая.
Нет никаких оснований считать, что хирургу, использующему промежностную РПЭ и получающему хорошие онкологические и функциональные результаты, стоит в обязательном порядке переходить к использованию другого метода. Так же нет оснований думать о том, что роботическая система сделает из плохого хирурга хорошего специалиста.
Таким образом, промежностная радикальная простатэктомия остается одним из возможных вариантов удаления предстательной железы при раке.
Литература
- Adams J. The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis. Lancet. 1853:393.
- Young HH. The early diagnosis and radical cure of carcinoma of the prostate: being a study of 40 cases and presentation of a radical operation, which was carried out in four cases. 1905. J Urol. 2002;167:939-46.
- Young HH. The cure of cancer of the prostate by radical perineal prostatectomy: history, literature and statistics of Young’s operation. J. Urol. 1945;53:188-256. DOI: 10.1016/S0022-5347(17)70130-9
- Walsh PC, Lepor H, Eggleston JC. Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations. Prostate. 1983;4(5):473-85.
- Weiss JP, Schlecker BA, Wein AJ, Hanno PM. Preservation of periprostatic autonomic nerves during total perineal prostatectomy by intrafascial dissection. Urology. 1985;26(2):160-3.
- Lepor H. A review of surgical techniques for radical prostatectomy. Rev Urol. 2005;7(2):11-7.
- Ли И.К. Анатомо-топографическое обоснование радикальной простатэктомии и тазовой лимфаденэктомии из промежностного доступа: Дис. … кандидата медицинских наук. Москва, 2006.
- Fichtner J, Gillitzer R, Melchior SW, Hohenfellner M, Thüroff JW. Perineal complications following radical perineal. Aktuelle Urol. 2003;34(4):223-5. DOI: 10.1055/ s-2003-41599
- Harris MJ. Radical perineal prostatectomy: cost efficient, outcome effective, minimally invasive prostate cancer management. Eur Urol. 2003;44(3):303-8.
- Bishoff JT, Motley G, Optenberg SA, Stein CR, Moon KA, Browning SM, Sabanegh E, Foley JP, Thompson IM. Incidence of fecal and urinary incontinence following radical perineal and retropubic prostatectomy in a national population. J Urol. 1998;160(2):454-8.
- Sammon JD, Trinh QD, Sukumar S, Ravi P, Friedman A, Sun M, Schmitges J, Jeldres C, Jeong W, Mander N, Peabody JO, Karakiewicz PI, Harris M. Risk factors for biochemical recurrence following radical perineal prostatectomy in a large contemporary series: A detailed assessment of margin extent and location. Urol Oncol. 2013;31(8):1470-6. DOI: 10.1016/j.urolonc.2012.03.013
Статья опубликована в журнале “Вестник урологии” №2 2018, стр. 76-84