Перкутанная нефролитотрипсия при инфицированной моче: дробить нельзя дренировать
И.А. Горгоцкий1, Д.Д. Шкарупа1,2, А.Г. Шкарупа1, Н.П. Ярова1, Н.Д. Кубин1, А.Д. Петров3
1 ФГБОУВО «Санкт-Петербургский государственный университет», Клиника высоких медицинских технологий им. Н.И. Пирогова Министерства образования Российской Федерации.
2 ФГБОУВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Министерства здравоохранения Российской Федерации. ФГБУ «НМХЦ им. Н.И. Пирогова» Министерства здравоохранения Российской Федерации.
Перкутанная нефролитотрипсия (ПНЛ) в настоящее время является наиболее эффективным методом лечения крупных, множественных и коралловидных камней почек. Внедрение в практику ПНЛ позволило практически полностью отказаться от открытых хирургических вмешательств, которые всегда сопряжены с длительным болевым синдромом у пациентов, а также с необходимостью продолжительного стационарного лечения [1,2]. ПНЛ в последнее десятилетие получило широкое распространение и в развивающихся странах, что обусловлено высоким ресурсом эндоскопов (нефроскопов), сравнительно недорогими расходными материалами и меньшей общей стоимостью лечения по сравнению с ретроградной уретеропиелолитотрипсией [3].
По современным литературным данным уровень инфекционно-воспалительных осложнений (лихорадка, обострение пиелонефрита) после ПНЛ составляет 21-74%, а частота развития сепсиса, являющегося наиболее частой причиной летального исхода, – 0,3-1,1% [4,5].
Согласно большинству клинических рекомендаций, плановое оперативное лечение камней почек не рекомендуется проводить при наличии положительного результата бактериологического исследования мочи из-за опасности развития инфекционно-воспалительных осложнений. В таких случаях предлагается дренировать верхние мочевыводящие пути (ВМП) внутренним мочеточниковым стентом или чрескожной нефростомой, а проведение ПНЛ выполнять вторым этапом после санации мочи [4,6,7]. Какова же необходимая длительность курса антибактериальной терапии? В литературе нам встретился ряд исследований, показывающих эффективность предоперационной антибиотикотерапии в течение одной недели до операции [8,9]. Однако добиться стерильного посева мочи в эти сроки удается не всегда. Кроме того, в некоторых случаях оперативному вмешательству подвергаются пациенты с положительным результатом посева мочи без предоперационной антибактериальной подготовки [2,10]. Предпосылками к проведению оперативного вмешательства в таком случае являются неэффективность предшествовавшей антибактериальной терапии (в том числе с предварительным дренированием ВМП), индивидуальная непереносимость стента или нефростомического дренажа, кроме того отдаленное место жительства пациента часто не позволяет провести полноценный курс антибактериальной терапии, который предполагает повторные визиты в клинику. То есть расширение показаний для перкутанного вмешательства без антибактериальной профилактики зачастую вызвано не только медицинскими причинами. Большое количество перкутанных операций в нашей клинике и расширение географии поступающих пациентов привело к образованию серии подобных наблюдений. В то же время подробные руководства по ведению таких пациентов нами в литературе не найдены.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании был оценены результаты 428 перкутанных литотрипсий, произведенных у 388 пациентов тремя хирургами с 2013 по 2017 гг. Лечение пациентов производилось в отделении урологии клиники Санкт-Петербургского государственного университета (Клиника высоких медицинских технологий им. Н.И. Пирогова). В I группе оценены результаты 254 (59,3%) операций у 236 больных, у которых при предоперационном обследовании посев мочи был стерильным. Во II группе изучены результаты 174 (40,7%) операций, выполненных у 152 пациентов, у которых результат посева мочи перед вмешательством был положительным. Стоит отметить, что в I группе 10 пациентов перенесли 2 ПНЛ, 2 пациента – 3 ПНЛ, 1 пациент – 5 ПНЛ (с обеих сторон), во II группе 14 пациентам выполнено – 2 ПНЛ, 1 пациенту – 3 ПНЛ, 2 пациентам – 4 ПНЛ (по поводу двустороннего нефролитиаза).
Мочу для посева получали из мочевого пузыря или из нефростомического дренажа, если лечение было этапным. Всем пациентам выполнялась спиральная компьютерная томография почек и мочевыводящих путей с контрастным усилением для определения функционального состояния почек, мочевыводящих путей, а также размеров, локализации, плотности и количества конкрементов. У всех пациентов по данным стандартного общего предоперационного обследования противопоказаний к оперативному лечению не выявлено. Все пациенты перед операцией подписывали информированное согласие. В исследование не вошли пациенты с аномалиями почек и мочевыводящих путей, почечной недостаточностью, единственной почкой, иммунодефицитом, сахарным диабетом, а также пациенты, получающие химиотерапию/глюкокортикоиды и с кишечной деривацией мочи. Оценивались такие факторы риска, как размер камня (в наибольшем измерении), наличие гидронефроза, ранее перенесенные и этапные вмешательства по поводу мочекаменной болезни, в частности – неудачная предшествовавшая дистанционная литотрипсия (ДЛТ). Основные характеристики групп приведены в таблице 1.
Таблица 1. Характеристики групп случаев
| Nп/п | Показатель | Группа I (n=254) ПНЛ | Группа II (174) ПНЛ | Р |
| 1 | Возраст, лет Мужчины/женщины |
50,6*12.5 120/134 |
54.5±13.8 80/94 |
|
| 2 | Справа/слева | 106/148 | 81/93 | |
| 3 | Размеры камня в наибольшем измерении, мм | 21,7±12,6 | 25.2±13,6 | ≤0.05 |
| 4 | Плотность камня, ни | 1130.5*392.5 | 1100.9*443,5 | >0.05 |
| 5 | Гидронефроз | 20(7.9%) | 16(9.2%) | >0.05 |
| 6 | Этапные (второе и более) вмешательства | 12(4.7%) | 13(7.4%) | >0.05 |
| 7 | Ранее установленный стент | 52 (20.5%) | 34(19.5%) | >0.05 |
| 8 | Ранее установленная нефростома | 16(6,3%) | 35 (20,1%) | ≤0.05 |
| 9 | Коралловидный камень | 70 (27.6%) | 59 (33.9%) | >0.05 |
| 10 | Неудачная ДЛТ | 40 (15.7%) | 51 (29,3%) | ≤0.05 |
Средний возраст пациентов I группы составил 50,6±12,5 лет, во II группе преобладали пациенты более старшего возраста и средний возраст был 54,5±13,8 лет. В обеих группах конкременты располагались преимущественно слева. В группе пациентов, имеющих положительный результат посева мочи, определялись конкременты больших размеров, в среднем – 25,2±13,6 мм, по сравнению с больными I – 21,7±12,6 мм (p≤0,05).
Кроме того во II группе удельный вес пациентов, которым ранее проводились операции с установкой нефростомического дренажа достоверно был выше по сравнению с I группой, 20,1% и 6,3% соответственно (p≤0,05). Если же ПНЛ предшествовало внутреннее стентирование мочеточника, то достоверных различий по результатам посева мочи между группами выявлено не было. Также во II группе определялось большее количество пациентов с предшествовавшей неудачнойДЛТ – 51 (29,3%) по сравнению с Iгруппой – 40 (15,7%) (p≤0,05). По остальным показателям группы пациентов оказались однородными.
Спектр выявленных микроорганизмов по данным бактериологического исследования у пациентов II группы представлен на рисунке 1.
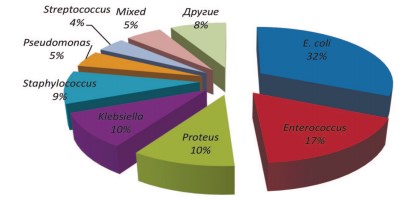
Рис. 1. Спектр выявленных микроорганизмов по данным бактериологического исследования у пациентов II группы.
Бактерии семейства Enterobacteriaceae и энтерококки составляли около половины всех выявленных патогенных микроорганизмов.
Техника вмешательства и послеоперационное ведение выполнялись согласно общепринятым протоколам. Всем пациентам предпринимались стандартные или миниПНЛ в положении на животе. Операция начиналась с катетеризации (стентирования) мочеточника на стороне поражения в литотомической позиции. Далее пациент переворачивался на живот, выполнялось ретроградное наполнение чашечно-лоханочной системы (ЧЛС) стерильным физиологическим раствором и производилась пункция почки иглой под комбинированным (ультразвуковым и рентгеновским) наведением с последующим проведением струны-проводника. Производилось одно- или двухэтапное бужирование с помощью пластиковых диляторов 20 или 30 Ch с установкой кожуха Amplatz, проведение нефроскопа. Под визуальным контролем выполнялась фрагментация камня с помощью ультразвуковой, пневматической или лазерной энергии с аспирацией или экстракцией фрагментов камня, ревизия ЧЛС гибким эндоскопом, установка в ЧЛС нефростомического дренажа 10 или 12 Ch.
В 1-е сутки после операции помимо контроля объективного клинического статуса и клинического анализа крови всем пациентам выполнялась нативная низкодозная компьютерная томография почек и мочевыводящих путей.
Протокол антибактериальной терапии для группы пациентов с отрицательным посевом мочи заключался в предоперационном (за 30 минут до вмешательства) введении препарата (цефалоспорин 3 поколения или фторхинолон) и далее ежедневно в терапевтической дозе, курс лечения составил 7 дней вне зависимости от срока удаления нефростомы. Для пациентов с положительным результатом посева мочи препарат назначался с учетом показателей антибиотикограммы за сутки и за 30 минут до операции и далее ежедневно, как в I группе пациентов. Все препараты назначались в терапевтических дозах с учетом веса пациента и почечной функции согласно локальным рекомендациям по рациональной фармакотерапии.
Для сравнения показателей использовался коэффициент Стьюдента и метод хи-квадрат.
РЕЗУЛЬТАТЫ
Продолжительность операции, размеры и количество доступов, длительность послеоперационного койко-дня не имели статистически достоверных различий между группами. Кровотечение во время операции и в послеоперационном периоде купировались консервативными методами, кровопотеря не потребовала гемотрансфузии ни у одного пациента. Основные результаты исследования приведены в таблице 2. Частота проявлений инфекционно-воспалительных осложнений также не различалась как по клиническим (наличие гипертермии), так и по лабораторным данным. Так, лейкоцитоз более 14*109/л имел место у 38 (14,9%) пациентов в I группе и у 29 (16,7%) – во II. Развитие сепсиса не отмечено ни у одного пациента. Общая эффективность операции составила более 70% как в первой, так и во второй группе
Таблица 2. Сравнение интра- и послеоперационных показателей, осложнений и результатов лечения
| №п/п | Показатель | Г pynna 1 (n=254) | Группа II (174) | Р |
| 1 | Среднее время операции, мин | 85.2±39.9 | 86.2±43.5 | >0.05 |
| 2 | Размер доступа 20-Ch 30-Ch | 55 (21.7%) 199 (78.3%) | 33(18.9%) 141 (81,1%) | >0.05 >0.05 |
| 3 | Два и более доступа | 17 (6.7%) | 17 (9.8%) | >0.05 |
| 4 | Лихорадка более 380 на 1-е сутки | 25 (9.8%) | 23(13.2%) | >0.05 |
| 5 | Средний уровень снижения гемоглобина (разница между исходным и значением на 1 сутки), г/л. | 11.0±5.6 | 14.8±8.8 | ≤0.05 |
| 6 | Уровень лейкоцитов в клиническом анализе крсеи на 1-е сутки А- Более 10*10° Б-Более 14’10* | 116(45.7%) 38(14.9%) | 85 (48.9%) 29(16.7%) | >0.05 |
| 7 | Наличие гематомы после операции (£103 мл) | 12 (4.7%) | 9(5.1%) | >0.05 |
| 8 | Длительность послеоперационных к/д | 4.1±1.7 | 4.2±2,2 | >0.05 |
| 9 | Отсутствие резидуальных (более 4 мм) фрагментов камня, stone-lree rate | 192(75.6%) | 127(72.9%) | >0.05 |
ОБСУЖДЕНИЕ
Общепринято, что обязательным условием для ПНЛ является наличие стерильного посева мочи перед операцией, а при наличии сопутствующей обструкции верхних мочевыводящих путей – предварительное дренирование чашечно-лоханочной системы и последующее этапное лечение [4,6]. С учетом недостаточного количества исследований по этой проблеме, данное положение имеет невысокий уровень доказательности (“C”), что предполагает возможность альтернативной тактики [6]. Так, в своих работах M. Etemadian и соавт. и M.Hossenini и соавт. предлагают при получении гнойной мочи при первичной пункции ЧЛС почки дальнейшее оперативное вмешательство не продолжать, а ограничиться нефростомией и последующим этапным лечением [10,11]. По их мнению, продолжение ПНЛ в условиях гнойной мочи приводит к повышенному риску инфекционно-воспалительных осложнений. В то же время M. Aron и соавт. в своем исследовании утверждает обратное [12]. Повышенный риск инфекционных осложнений у пациентов с ранее установленной нефростомой отмечают в своем исследовании и K. Sharma и соавт., которые считают что, причиной таких осложнений, помимо всего прочего, могут быть бактериальные биопленки на поверхности дренажа [13]. В нашем исследовании получены похожие результаты, тем не менее стоит отметить, что предшествующее дренирование полостной системы почки внутренним мочеточниковым стентом не меняло степени бактериальной нагрузки.
Одним из факторов инфекционных осложнений являются множественные чрескожные доступы, что подтверждается в работах ряда авторов [13,14]. В нашем исследовании также прослеживается тенденция к увеличению инфекционных осложнений при множественных доступах, тем не менее, различия между группами оказались статистически недостоверны. Как правило, множественные доступы необходимы при лечении сложных коралловидных камней, которые уже сами по себе являются фактором большинства осложнений при ПНЛ [14].
Многие исследователи в своих работах подчеркивают, что большинство камней, в том числе и считающиеся неинфекционными (такие, как оксалаты), содержат в себе бактерии и бактериальные липополисахариды, которые сами по себе являются основными медиаторами системного воспалительного процесса и сепсиса [15,16]. При ДЛТ, когда повреждается камень и увеличивается его суммарная поверхность, можно предположить переход бактерий из конкремента в планктонное состояние, в результате ранее стерильный посев мочи становится положительным. В нашем исследовании также отмечено достоверно большее количество пациентов после перенесенной ДЛТ во II группе по сравнению c I. К сожалению, в нашем исследовании информации о бактериальном факторе конкремента нет, так как исследовать собственно камень возможно лишь после его извлечения. Поэтому для предупреждения развития инфекционных осложнений метод культурального исследования конкремента нами не был использован.
Сепсис – это тяжелое гнойносептическое осложнение, угрожающее жизни пациента. Определение состояния «сепсис» периодически пересматривается и меняется. Зачастую сепсис отождествляется с синдромом системной воспалительной реакции (ССВР) [17]. Общепринятый факт, что предлагаемые ССВР параметры могут иметь место и при обострении инфекции как мочевыводящих путей, так и других локализаций без септического течения. Необходимо отметить, что согласно консенсусу 2016 года, понятия ССВР и сепсиса диверсифицированы с обоснованием принятия более целесообразных критериев сепсиса по шкале SOFA [18]. В большинстве публикаций, посвященных инфекционно-воспалительным осложнениям в эндоурологии, сепсис классифицировался именно по шкале ССВР. Возможно поэтому в ряде клинических работ частота подобных осложнений достигает 43% [19]. Наличие транзиторного повышения температуры тела на 1-е-2-е сутки после операции можно рассматривать и как реакцию на наличие послеоперационной гематомы или же как манифестацию пиелонефрита [2]. Однако клиническая оценка отличий подобных состояний представляется затруднительной. При оценке пациентов по шкале SOFA в нашем исследовании признаков сепсиса не было отмечено ни у одного больного из обеих групп. По данным I.H. Bozkurt, еще одним дополнительным критерием септического течения может являться уровень лейкоцитов более 14*109/л в клиническом анализе крови на первые сутки после операции. Мы также оценивали этот показатель и различий между группами не получили [20].
В посевах мочи у пациентов II группы бактерии семейства Enterobacteriaceae и энтерококки составляли около половины всех выявленных патогенных микрооргнизмов. По данным глобального исследования CROES 2013 года на всех континентах отмечена различная частота встречаемости и спектры устойчивости патогенных микроорганизмов в моче [2]. Кроме того установлено, что бактерии групп Enterobacter spp. и Klebsiella spp. в большей степени способствуют развитию гипертермии в послеоперационном периоде. Повышение температуры тела до 38оС было отмечено у 23 больных II группы, что составило 13,2%. По данным исследования CROES частота гипертермии у подобных пациентов составила 18,2%, что не противоречит нашим результатам. Возможно, полученные нами данные, в отличие от исследований с противоположными результатами, могут быть связанны с локальными особенностями микроорганизмов и отсутствием региональной резистентности к использованным нами антибактериальным препаратам.
ВЫВОДЫ
Получение положительного результата посева мочи не предполагает обязательное предварительное дренирование ВМП перед ПНЛ. Инфицированная моча не является независимым фактором риска послеоперационных инфекционно-воспалительных осложнений при проведении ПНЛ. Предварительное назначение антибактериального препарата за 24 часа до операции с учетом данных бактериологического исследования мочи может рассматриваться как альтернатива однонедельному курсу и позволяет производить ПНЛ с приемлемыми показателями безопасности у пациентов с положительным посевом мочи.
ЛИТЕРАТУРА
- Jayram G, Matlaga BR. Contemporary practice patterns associated with percutaneous nephrolithotomy among certifying urologists. J Endourol 2014; 28(11):1304-1307. doi: 10.1089/end.2014.0465.
- Gutierrez J, Smith A, Geavlete P, Shah H, Kural AR, de Sio M, et al. Urinary tract infections and post-operative fever in percutaneous nephrolithotomy. World J Urol 2013;31:1135–1140. doi: 10.1007/s00345-012-0836-y.
- Patel SR, Nakada SY. e modern history and evolution of percutaneous nephrolithotomy. J Endourol 2015; 29(2): 153-157. doi: 10.1089/end.2014.0287
- Türk C, Neisius A, Petrik A, Seitz C, Skolarikos A, Tepeler A, et al. EAU Guidelines on urolithiasis 2017. Avaliable at: http://uroweb.org/guideline/urolithiasis/Accessed October, 27, 2017.
- Gravas S, Montanari E, Geavlete P, Onal B, Skolarikos A, Pearle M, et al. Postoperative infection ratesin lowrisk patients undergoing percutaneous nephrolithotomywith andwithout antibiotic prophylaxis: a matched case control study. J Urology 2012;188:843-847. doi: 10.1016/j.juro.2012.05.007.
- Assimos D, Krambeck A, Miller NL, Monga M, Murad H, Nelson CP, et al. Surgical Management of Stones: American Urological Association/Endourological Society Guideline. J Urol 2016;196:1153-1160. doi: 10.1016/j.juro.2016.05.090.
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М.: ГЭОТАР-Медиа, 2016, 496 С.
- Mariappan P, Smith G, Moussa SA, Tolley DA. One week of ciprofloxacin before percutaneous nephrolithotomy significantly reduces uppertract infection and urosepsis: a prospective controlled study. BJU Int 2006; 98(5):1075–1079. doi 10.1111/j.1464-410X.2006.06450.x
- Bag S, Kumar S, Taneja N, Sharma V, Mandal AK, Singh SK. One week of nitrofurantoin before percutaneous nephrolithotomy significantly reduces uppertract infection and urosepsis:a prospective controlled study. Urology 2011; 77(1):45–49. doi: 10.1016/j.urology.2010.03.025
- Etemadian M, Haghighi R, MadianeayA, TizenoA, Fereshtehnejad SM. Delayed Versus Same-Day Percutaneous Nephrolithotomy in Patients With Aspirated Cloudy Urine. Urol J 2008; 5:28-33.
- Hossenini MM, Basiri A, Moghaddam H. Percutaneous Nephrolithotomy of Patients with Staghorn Stone and Incidental Purulent Fluid Suggestive of Infection. J Endourol 2007; 21 (12); 1429-1432. doi: 10.1089/end.2007.0092.
- Aron M, Goel R, Gupta NP, Seth A. Incidental detection of purulent fluid in kidney at percutaneous nephrolithotomy for branched renal calculi. J Endourol 2005; 19 (2):136-139. doi: 10.1089/end.2005.19.136.
- Sharma K, Narayan S, Goel A, Singh V, Sharma P, Garg Y. Factors predicting infectious complications following percutaneous nephrolithotomy. Urol Ann 2016;8(4), 434-438. doi: 10.4103/0974-7796.192105.
- Wollin DA, Joyce AD, Gupta M, Wong MYC, Laguna P, Gravas S, et al. Antibiotic use and the prevention and management of infectious complications in stone disease. World J Urol 2017; 35(9):1369-1379. doi: 10.1007/s00345-017-2005-9.
- Fowler JE Jr. Bacteriology of branched renal calculi and accompanying urinary tract infection. J Urol 1984; 131:213–215.
- McAleer I, KaplanGW, Bradley JS. Endotoxin content in the renal calculi. J Urol 2003; 169:1813–1814. doi: 10.1097/01.ju.0000061965.51478.79
- Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992; 20(6):864-874.
- Singer M, DeutschmanCS, SeymourCW, Shankar-Hari M,Annane D, Bauer M, et al.Consensus Definitions for Sepsis and Septic Shock. JAMA 2016; 315(8):801-810. doi:10.1001/jama.2016.0287
- Moses RA, Agarwal D, Raffin EP, Viers BR, Sharma V, Krambeck AE, et al. Postpercutaneous Nephrolithotomy Systemic Inflammatory Response Syndrome Is Not Associated With Unplanned Readmission. Urology 2017; 100:33–37. doi: 10.1016/j.urology.2016.09.012.
- Bozkurt IH, Aydogdu O, Yonguc T, Koras O, Sen V, Yarimoglu S, et al. Predictive Value of Leukocytosis for Infectious Complications After Percutaneous Nephrolithotomy. Urology 2015; 86 (1): 25-29. doi:10.1016/j.urology.2015.04.0260090-4295/15
Статья опубликована в журнале”Экспериментальная и клиническая урология” №3 2018, стр.28-33