Отдаленные результаты цистэктомии и двустороннего уретеросигмоанастомоза у больной с экcтрофией мочевого пузыря
Г.В. Учваткин 1, 2 , Н.Г. Капустин 2 , Н.Д. Ерохина 1 , И.В. Кузьмин 1
1ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России; 2ГБУЗ «Ленинградская областная клиническая больница», Санкт-Петербург
Экстрофия мочевого пузыря — порок развития мочевой системы, при котором отсутствуют нижнесрединная часть передней брюшной стенки и передняя стенка мочевого пузыря. Считается наиболее тяжелым пороком развития мочевой системы. Экстрофия мочевого пузыря часто сочетается с пороками развития верхних мочевых путей, эписпадией и другими аномалиями (крипторхизм, анальные свищи, открывающиеся в мочевой пузырь либо промежность, выпадение прямой кишки), сопровождается расхождением лонных костей [1]. Экстрофия мочевого пузыря формируется на 5–6-й неделе беременности в результате нарушения развития клоакальной мембраны, закрывающей нижние отделы передней брюшной стенки, и каудального сращения половых бугорков. В результате этого мочевой пузырь оказывается без передней стенки.
Частота экстрофии мочевого пузыря оценивается как 1 : 30 000–1 : 50 000 среди всех новорожденных [2]. У мальчиков этот порок развития встречается значительно чаще, чем у девочек [3]. На сегодняшний день широко распространена гипотеза, что экстрофия мочевого пузыря является генетически детерминированным заболеванием, о чем, в частности, свидетельствует повышенный риск развития экстрофии мочевого пузыря у близких родственников [4].
Лечение экcтрофии мочевого пузыря только хирургическое, причем операцию необходимо выполнять в первые дни жизни ребенка [1]. Впервые оперативное вмешательство у больного с экстрофией мочевого пузыря было осуществлено в 1851 г., когда J. Simon выполнил уретеросигмостомию [5]. В дальнейшем отведение мочи в& сигмовидную кишку приобрело широкое распространение, появилось множество модификаций этой операции, однако с накоплением опыта были выявлены серьезные недостатки данного метода. Рецидивирующее течение пиелонефрита, прогрессирование хронической почечной недостаточности, метаболические нарушения, выявление в отдаленном периоде злокачественных опухолей толстой кишки послужили причиной поиска более приемлемых вариантов деривации мочи [6, 7].
Современная концепция восстановления полноценной жизни детей с экстрофией мочевого пузыря заключается в ликвидации недержания мочи, профилактике инфекции мочевыводящих путей, восстановлении наружных половых органов и социальной реабилитации [7–10]. Рекомендуется придерживаться трехэтапного хирургического лечения экстрофии мочевого пузыря: I этап — закрытие мочевого пузыря со сведением лонных костей; II этап — реконструкция эписпадии у мальчиков, которую осуществляют в возрасте 2–3 лет; III этап — пластика шейки мочевого пузыря либо аугментационная цистопластика (если мочевой пузырь недостаточного размера) [1].
Независимо от метода оперативного вмешательства по поводу экстрофии мочевого пузыря в позднем послеоперационном периоде часто развивается рецидивирующий пиелонефрит, мочекаменная болезнь и хроническая почечная недостаточность [11, 12], поэтому такие больные должны находится под постоянным диспансерным наблюдением.
В настоящей работе представлен клинический случай, показывающий отдаленные результаты выполненных в детском возрасте цистэктомии и двустороннего уретеросигмоанастомоза у больной с экстрофией мочевого пузыря.
Больная С., 37 лет, переведена из хирургического отделения районной больницы Всеволожского района в отделение реанимации и интенсивной терапии Ленинградской областной клинической больницы 16.03.2017 с диагнозом: «Острый гнойный пиелонефрит слева. Уросепсис. Хроническая почечная недостаточность». При поступлении больная в крайне тяжелом состоянии. В виду выраженного бронхоспазма переведена на искусственную вентиляцию легких. Из беседы с родственниками и изучения записей медицинской документации было выяснено, что у больной имелся порок развития — экстрофия мочевого пузыря. В возрасте 1 года была выполнена цистэктомия и пересадка мочеточников в сигмовидную кишку. В дальнейшем наблюдалась у уролога по месту жительства, отмечались обострения хронического пиелонефрита с частотой 2–3 раза в год с двух сторон. В возрасте 15 лет при контрольном обследовании выявлена вторично-сморщенная правая почка с отсутствием ее функции.
02.03.2017 появились тянущие боли в поясничной области слева, сопровождавшиеся субфебрильной лихорадкой. Лечилась дома самостоятельно. 15.03.2017 отмечено ухудшение состояния, повышение температуры тела до 38 °C с ознобом, усилились боли в поясничной области слева. 16.03.2017 в связи с продолжающейся лихорадкой, болями, снижением количества мочи и эпизодами спутанности сознания в экстренном порядке была доставлена в хирургическое отделение районной больницы.
Результаты объективного осмотра: АД 90/50 мм рт. ст., пульс 91 в минуту, живот мягкий, не вздут. Область левой почки резко болезненна. Суточный диурез около 500 мл. При лабораторных исследованиях отмечается лейкопения до 3,06 • 109 /л, сдвиг лейкоцитарной формулы влево, повышение С-реактивного белка до 177 мг/л, креатинина до 780 мкмоль/л, мочевины до 47 ммоль/л, уровень прокальцитонина составил 62 нг/мл (норма 0–0,5 нг/мл). При УЗ-диагностике подтверждение диагноза — вторично-сморщенная правая почка, расщепленный тип строения полостной системы левой почки. При компьютерной томографии — увеличение размеров левой почки с отеком ее паренхимы. На основании этого поставлен диагноз: «Аномалия развития мочевыделительной системы. Экстрофия мочевого пузыря. Хронический пиелонефрит, активная фаза. Уросепсис. Септический шок. Вторично-сморщенная правая почка. Состояние после цистэктомии и двустороннего уретеросигмоанатосмоза». Проведен консилиум, и было принято решение об оперативном вмешательстве. В связи с наличием единственной функционирующей левой почки и возможностью вынужденной нефрэктомии, больная и ее родственники были информированы о возможности удаления левой почки и перехода на хронический гемодиализ. В ходе оперативного вмешательства выявлена увеличенная в размерах левая почка, плотно спаянная с окружающей клетчаткой, множественные карбункулы, занимающие практически всю поверхность почки, при надсечении которых выделялся густой сливкообразный гной. Принято решение о нежизнеспособности левой почки, с целью ликвидации очага, приведшего к развитию сепсиса, было принято решение о выполнении нефрэктомии слева. Выполнена типичная нефрэктомия с адекватным дренированием забрюшинного пространства (рис. 1). На рану наложены редкие сводящие швы.
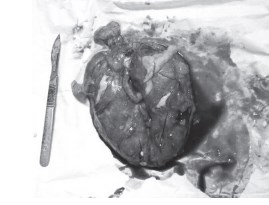
Рис. 1. Удаленная левая почка с множественными карбункулами
Дальнейшее лечение проводилось в условиях отделения интенсивной терапии с применением антибактериальных препаратов широкого спектра действия, введения адреномиметиков. Состояние пациентки оставалось крайне тяжелым. С 18.03.2017 начаты сеансы гемодиализа. На фоне проводимой терапии состояние медленно улучшалось, стабилизировались гемодинамические показатели. Отмечалось снижение уровня прокальцитонина до 1,74 нг/мл, лейкоцитоза до 9,02 ∙ 109 /л. Всего за время лечения выполнено 30 сеансов гемодиализа. 10.04.2017 в состояние средней степени тяжести пациентка переведена в отделение урологии, где продолжала получать заместительную, восстановительную терапию и ЛФК. В дальнейшем больная выписана в удовлетворительном состоянии для проведения хронического гемодиализа. Через 1 год наблюдения состояние больной удовлетворительное.
Таким образом, данный клинический случай является подтверждением высокого риска развития нарушения функции и инфекционных поражений почек у больных с двусторонним уретеросигмоанастомозом. В настоящее время данная операция из-за высокой частоты осложнений не рассматривается в качестве операции выбора у больных с экстрофией мочевого пузыря, наиболее рациональным методом деривации мочи является создание ортотопического мочевого пузыря.
Согласно клиническим рекомендациям Союза педиатров России «Экстрофия мочевого пузыря» (2015), пациентам, оперированным по поводу этого состояния показано диспансерное наблюдение, включающее в себя: oсмотр нейроуролога/уролога (при недержании мочи) — 1 раз в 3–6 месяцев для коррекции терапии; уролога/хирурга (1 раз в 6 месяцев первые 5 лет, затем 1 раз в год и по показаниям); физиотерапевта (не реже 1 раза в год и по показаниям); нефролога — по показаниям (при нарушении функции почек), а также выполнение лабораторных исследований: общего анализа мочи (1 раз в 3 месяца и/или по показаниям); ультразвукового исследования органов мочевой системы (1 раз в 6 месяцев и/или по показаниям); посева мочи с определением чувствительности к антибиотикам (по показаниям при изменениях в анализах мочи) [1].
Литература
- Экстрофия мочевого пузыря. Клинические рекомендации Союза педиатров России. – 2015 г. – 29 с. [Ekstrofija mochevogo puzyrja. Klinicheskie rekomendacii Sojuza pediatrov Rossii. 2015. 29 p. (In Russ.)]. Доступно по: http://www.pediatr-russia.ru/ sites/default/files/file/kr_emp.pdf.
- Siffel C, Correa A, Amar E, et al. Bladder exstrophy: An epidemiologic study from the International Clearinghouse for Birth Defects Surveillance and Research, and an overview of the literature. Am J Med Genet C Semin Med Genet. 2011;157(4):321-332. doi: 10.1002/ajmg.c.30316.
- Hsieh K, O’Loughlin MT, Ferrer FA. Bladder exstrophy and pheontypic gender determination on fetal magnetic resonance imaging. Urology. 2005;65(5):998-999. doi: 10.1016/j.urology.2004.12.060.
- 4. uzuki K, Matsumaru D, Matsushita S, et al. Epispadias and the associated embryopathies: Genetic and developmental basis. Clin Genet. 2017;91(2):247-253. doi: 10.1111/cge.12871.
- Simon J. Ectopia vesicae (absence of the anterior walls of bladder and pubic abdominal parietes); operation for directing the orifices of ureters info the rectum; temporary success; subsequent death; autopsy. Lancet. 1852;2(2):568-570.
- Stockle M, Becht E, Voges G, et al. Ureterosigmoidostomy: an outdated approach to bladder extrophy? J Urol (Baltimore). 1990;143(4):770-774.
- Осипов И.Б., Казачков С.А., Смирнова Л.П., Попова Е.Д. Выбор метода оперативного лечения экстрофии мочевого пузыря // Урология и нефрология. – 1996. – № 5. – С. 21–26. [Osipov IB, Kazachkov SA, Smirnova LP, Popova ED. Vybor metoda operativnogo lechenija jekstrofii mochevogo puzyrja. Urologija i nefrologija. 1996;(5):21-26. (In Russ.)]
- Шуваев А.В., Хватынец Н.А. Экстрофия мочевого пузыря: варианты хирургического лечения и контроль за инфекцией мочевых путей // Педиатрия. Журнал им. Г.Н. Сперанского. – 2015. – Т. 94. – № 3. – C.111–113. [Shuvaev AV, Hvatynec NA. Ekstrofija mochevogo puzyrja: varianty hirurgicheskogo lechenija i kontrol’ za infekciej mochevyh putej. Pediatrija. Zhurnal im. G.N. Speranskogo. 2015;94(3):111-113. (In Russ.)]
- Лебедев Д.А., Осипов И.Б., Бурханов В.В., Сарычев С.А. Эндоскопические вмешательства при экстрофии мочевого пузыря у детей // Воронцовские чтения. Материалы X юбилейной научно-практической конференции. – СПб., 2017. – С. 57–58. [Lebedev DA, Osipov IB, Burhanov VV, Sarychev SA. Endoskopicheskie vmeshatel’stva pri ekstrofii mochevogo puzyrja u detej. In: Voroncovskie chtenija. (Conference proceedings) X jubilejnaya nauchno-prakticheskaya konferenciya. Saint Petersburg; 2017. P. 57-58. (In Russ.)]
- O’Kelly F, Keefe D, Herschorn S, et al. Contemporary issues relating to transitional care in bladder exstrophy. Can Urol Assoc J. 2018;12(4, Suppl.1):S15-S23. doi: 10.5489/cuaj.5313.
- Bolduc S, Capolicchio G, Upadhyay J, et al. The fate of the upper urinary tract in exstrophy. J Urol. 2002;168(6):2579-2582. doi: 10.1097/01.ju.0000037500.96753.f9.
- Крышко Д.К., Осипов И.Б., Горелов С.И., Каган О.Ф. Отдаленные результаты реконструктивно-пластических операций на мочевом пузыре, выполненных в детском возрасте // Вестник Санкт-Петербургского университета. Серия 11. Медицина. – 2008. – Приложение к выпуску 1. – С. 209–218. [Kryshko DK, Osipov IB, Gorelov SI, Kagan OF. Results of reconstructive and plastic operations on urine bladder performed at children’s age. Vestnik Sankt-Peterburgskogo universiteta. Serija 11. Medicina. 2008;(Suppl.1):209-218. (In Russ.)]
Статья опубликована в журнале “Урологические ведомости” 2018 №2, стр. 73-76